Alzheimer ultime novità: scienziati scoprono come far guarire cellule malate.
L’Alzheimer è la forma più comune di demenza, rappresentando il 60-80% di tutti i casi di demenza. Nonostante i progressi nella comprensione di questa malattia neurodegenerativa, mancano ancora trattamenti efficaci.
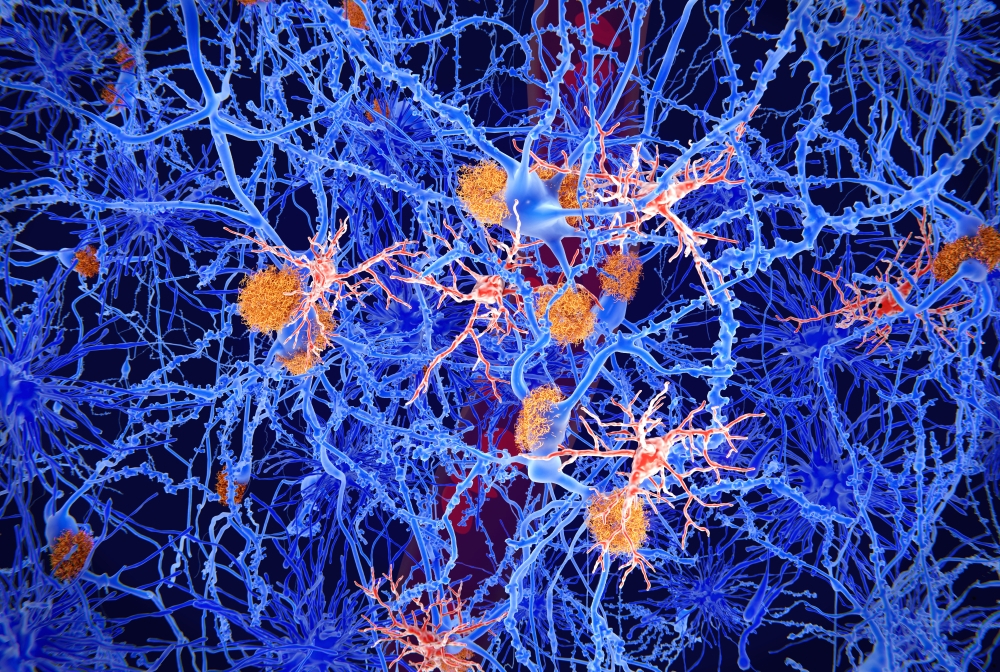
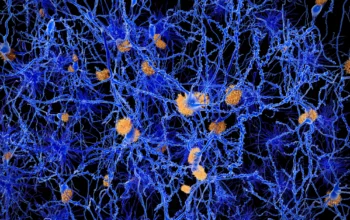
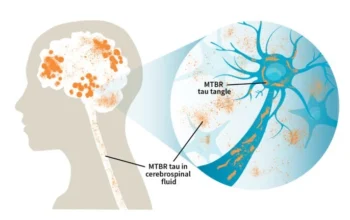
L’accumulo di proteine beta-amiloide in grumi o placche è uno dei tratti distintivi dell’Alzheimer. Una notevole mole di ricerca si è concentrata sulle mutazioni che portano all’elaborazione anormale della proteina beta-amiloide e, successivamente, al suo accumulo.
Tuttavia, i trattamenti mirati ai percorsi coinvolti nell’elaborazione dell’amiloide-beta non hanno avuto successo.
Il ruolo della microglia
I ricercatori hanno scoperto che spesso le persone con Alzheimer non mostrano mutazioni nei geni associati all’accumulo della proteina amiloide. Al contrario, prove recenti suggeriscono che gli individui affetti dal morbo mostrano spesso deficit nella rimozione dell’amiloide-beta ripiegata in modo errato.
Ciò può essere dovuto alla disfunzione della microglia, che sono le cellule immunitarie primarie nel cervello. Una delle funzioni della microglia include la fagocitosi, un processo che coinvolge l’ingestione di cellule morte, agenti patogeni e proteine mal ripiegate per facilitarne la rimozione.
Vi sono prove crescenti che la capacità della microglia di rimuovere la proteina beta-amiloide può essere compromessa nella sindrome del morbo di Alzheimer. La microglia può anche contribuire allo sviluppo dell’Alzheimer secernendo proteine infiammatorie e provocando un’eccessiva rimozione di neuroni e sinapsi, i legami tra i neuroni che consentono loro di “comunicare”.
Oltre all’Alzheimer, ci sono prove che suggeriscono che anche la microglia possa contribuire allo sviluppo di altre malattie neurodegenerative.
Tuttavia, i meccanismi molecolari alla base dell’ampia gamma di funzioni svolte dalla microglia in condizioni normali e malattie come l’Alzheimer non sono ben compresi.
Come la tecnologia CRISPR può aiutare
Lo screening genetico funzionale è uno strumento utilizzato per identificare i geni coinvolti in una specifica funzione cellulare. Tali schermi comportano l’inibizione o l’attivazione di un gene specifico in una cellula per valutare se il cambiamento nei livelli di espressione di quel gene influisca su una certa funzione di interesse, come la proliferazione cellulare.
Negli ultimi anni, i ricercatori hanno adattato lo strumento di modifica genetica noto come CRISPR-Cas9 per identificare i geni coinvolti in varie malattie, incluso il cancro. I vantaggi della piattaforma di screening CRISPR includono la sua maggiore sensibilità e una maggiore riproducibilità rispetto ai metodi di screening utilizzati in precedenza.
CRISPR-Cas9 è costituito da un piccolo pezzo di RNA chiamato sequenza guida e dall’enzima Cas9. L’RNA guida si lega alla regione del DNA di interesse, consentendo a Cas9 di legare e scindere il DNA nel sito mirato.
Nel presente studio, i ricercatori hanno utilizzato un sistema CRISPR-Cas9 modificato che coinvolge un enzima Cas9 (dCas9) disattivato che non scinde il DNA. Oltre all’enzima Cas9 disattivato, la piattaforma CRISPR-dCas9 modificata è costituita anche da proteine che possono sovraregolare o sottoregolare il gene di interesse o, in altre parole, attivarle e disattivarle.
Tali schermi CRISPR comportano la consegna dell’RNA guida alla cellula con l’aiuto di un virus geneticamente modificato, un vettore virale. Tuttavia, l’utilizzo di virus per fornire l’RNA guida alla microglia matura è stato impegnativo.
Utilizzo delle cellule staminali per la riparazione
Per aggirare queste difficoltà, i ricercatori hanno utilizzato cellule staminali pluripotenti indotte (IPSC). Gli IPSC sono derivati dalla riprogrammazione di cellule adulte da tessuti come pelle, capelli o sangue, in uno stato embrionale.
Simili alle cellule staminali dell’embrione, queste iPSC possono maturare per formare qualsiasi tipo di cellula desiderato, inclusi neuroni o microglia. Il vantaggio dell’utilizzo di cellule derivate da iPSC è che assomigliano più strettamente alle cellule umane rispetto alle linee cellulari convenzionali.
Inoltre, le microglia dei topi e dell’uomo differiscono nelle molecole rilasciate durante una risposta immunitaria. Pertanto, le microglia derivate da iPSC umane rappresentano un modello migliore per comprendere come i geni regolano le funzioni della microglia.
Nel presente studio, i ricercatori hanno utilizzato linee di cellule staminali pluripotenti indotte, che sono state modificate per esprimere i geni che codificano per il macchinario CRISPR-dCas9. Il macchinario CRISPR nelle iPSC era, tuttavia, inattivo e poteva essere attivato solo in presenza dell’antibiotico trimetoprim.
I ricercatori hanno quindi utilizzato vettori virali per fornire RNA guida alle iPSC. Le iPSC utilizzate dai ricercatori sono state geneticamente modificate per differenziarsi o maturare rapidamente in cellule simili a microglia dopo l’esposizione a un mezzo di coltura specializzato.
Dopo aver differenziato le iPSC in cellule microgliali, i ricercatori hanno attivato il macchinario CRISPR aggiungendo trimetoprim al mezzo di coltura cellulare. Ciò significa che, sebbene gli scienziati abbiano introdotto gli RNA guida nelle iPSC, i geni presi di mira dagli RNA guida sono stati attivati o inibiti solo dopo che le iPSC sono state differenziate in cellule simili a microglia.
Se l’espressione di questi geni mirati viene interrotta, ciò potrebbe influire negativamente sullo sviluppo della microglia. Ciò potrebbe rendere difficile distinguere se il cambiamento nell’espressione dei geni mirati abbia influito sullo sviluppo della microglia o sulla funzione della microglia adulta.
Questa nuova piattaforma CRISPR consente quindi agli scienziati di valutare la funzione genica nella microglia adulta.
Riportare le cellule sulla strada giusta
I ricercatori hanno utilizzato il sequenziamento dell’RNA a livello di singola cellula per caratterizzare diversi stati microgliali. Sulla base delle differenze nei profili di espressione genica, i ricercatori sono stati in grado di caratterizzare nove stati microgliali distinti.
Ad esempio, uno degli stati funzionali era caratterizzato dall’aumentata espressione del gene SPP1 che è sovraregolato nella microglia nell’AD e in altre condizioni neurodegenerative. Inoltre, inibendo l’espressione dei geni utilizzando la piattaforma CRISPR, i ricercatori sono stati in grado di identificare i geni che regolano l’adozione di questi stati funzionali. Ad esempio, i ricercatori hanno scoperto che la downregulation del gene del recettore del fattore 1 stimolante le colonie (CSF1R) utilizzando la piattaforma CRISPR ha ridotto il numero di cellule che esprimono livelli elevati del gene SPP1.
Gli scienziati hanno osservato una riduzione simile del numero di microglia nello stato malato di SPP1 utilizzando un farmaco che inibisce la proteina CSF1R. Pertanto, prendendo di mira i geni – o le proteine codificate da questi geni – che regolano lo stato di malattia, gli scienziati potrebbero riportare la microglia a uno stato sano. Tali risultati mostrano che questa piattaforma basata su CRISPR potrebbe essere utilizzata per identificare i geni che regolano gli stati microgliali associati a condizioni neurodegenerative. Ciò potrebbe successivamente aiutare gli scienziati a sviluppare trattamenti mirati a questi geni o ai prodotti genici.
“Gli schermi CRISPR nella microglia umana hanno il potenziale per scoprire bersagli terapeutici che possono ‘riprogrammare’ la microglia per migliorare le loro funzioni benefiche e bloccarne la tossicità nella malattia”, ha spiegato l’autore principale dello studio, il dottor Martin Kampmann, professore all’Università della California, SF.
(Fonte: medicalnewstoday.com)